Qué son las distrofias de la retina?
Las distrofias retinianas son un conjunto heterogéneo de enfermedades hereditarias que provocan una pérdida progresiva y severa de visión, dado que alteran la anatomía y/o la función de la retina. Actualmente no tienen cura, aunque se está investigando para poder tratarlas, en los próximos años, con terapias génicas y celulares.
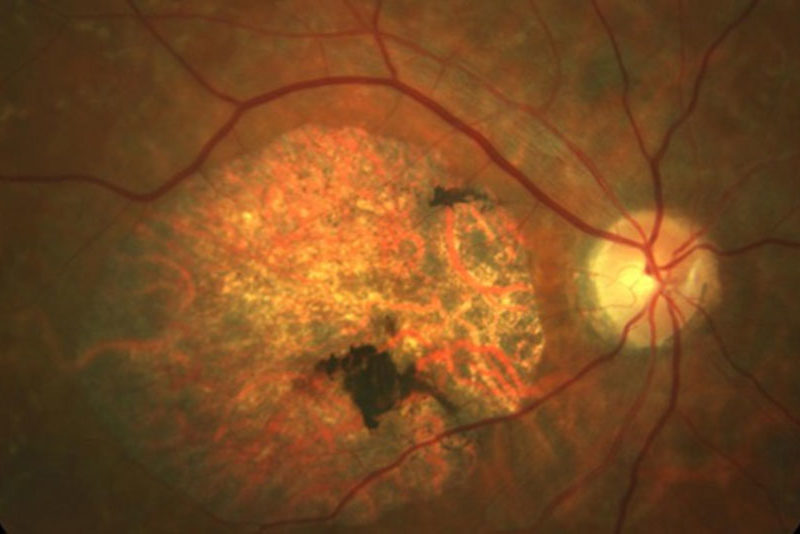
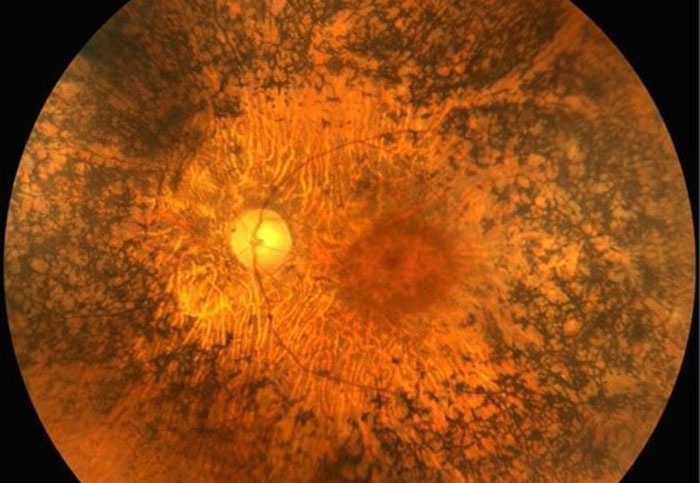
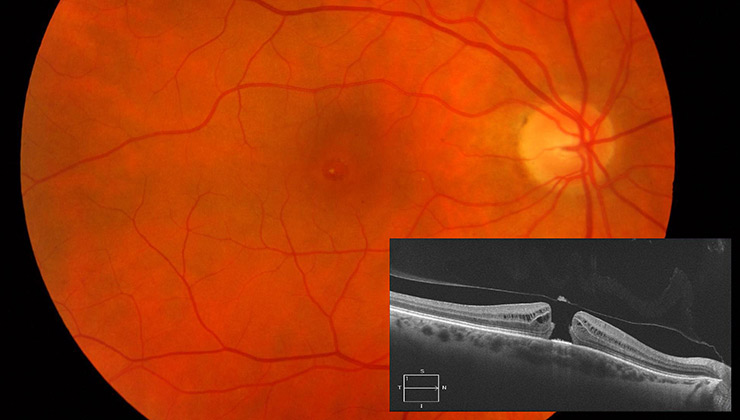
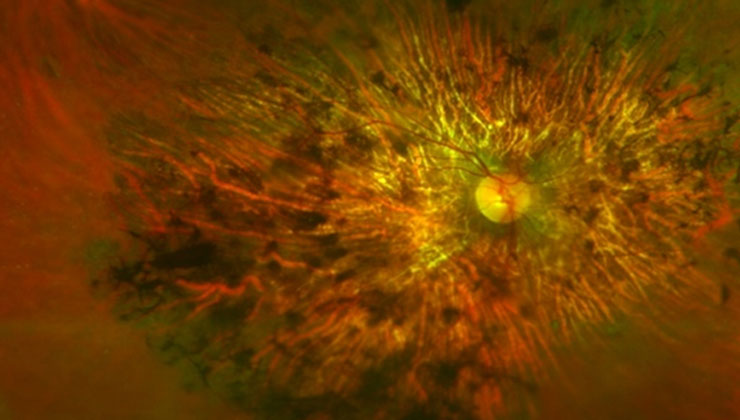
Estas patologías pueden causar un daño en las células fotorreceptoras, bien sean, predominantemente, los conos (responsables de la visión en detalle y de color), los bastones (especializados en la visión nocturna y periférica) o ambos a la vez. Es el caso de la enfermedad de Stargardt, la retinosis pigmentaria o la distrofia de conos-bastones, respectivamente.
También hay ciertas distrofias hereditarias, como la retinosquisis juvenil, la vitreoretinopatía exudativa familiar o el síndrome de Stickler, en las que se producen alteraciones del vítreo y de la retina. En otras, como la coroideremia, el problema de base está en la coroides, capa situada por debajo de la retina.
La mayoría de distrofias de retina son enfermedades localizadas exclusivamente en el ojo, aunque a veces pueden asociarse a manifestaciones extraoculares (síndrome de Usher, síndrome de Bardet-Biedl) en cuyo caso hablamos de distrofias retinianas sindrómicas.
Por su baja prevalencia, las distrofias de la retina son consideradas enfermedades minoritarias o “raras” (afectan a menos de 1 de cada 2.000 personas).
¿Por qué se producen?
Las distrofias de la retina tienen origen genético, por lo que pueden transmitirse de generación en generación mediante diferentes tipos de herencia.
- Herencia dominante: suelen haber afectados en todas las generaciones de la familia, ya que las personas portadoras de la mutación responsable de la enfermedad presentan la patología. Esta se transmite aproximadamente al 50% de los descendientes, como la enfermedad de Best.
- Herencia recesiva: habitualmente solo hay familiares afectos en una generación, ya que los pacientes portadores de una mutación están sanos, mientras que los portadores de dos mutaciones en el mismo gen desarrollan la enfermedad. Así ocurre en la enfermedad de Stargardt.
- Herencia ligada al cromosoma X: únicamente los hombres de la familia padecen la patología, aunque las mujeres pueden ser portadoras de la mutación y transmitir la enfermedad a sus hijos varones con un 50% de probabilidad. En este grupo se engloba, entre otras, la coroideremia.
La retinosis pigmentaria, la distrofia de la retina más frecuente, es un ejemplo de patología que puede transmitirse a través de los tres patrones de herencia mencionados, en función del gen implicado.
La genética de las distrofias de retina es compleja: una misma patología puede estar causada por varios genes y, a la vez, un mismo gen puede estar relacionado con diferentes enfermedades. Actualmente, se han descrito más de 250 genes asociados a las distrofias retinianas, aunque se estima que todavía faltan muchos por identificar.
¿Cómo se pueden prevenir?
La información genética contenida en el ADN de cada persona es la que determina que se desarrolle una distrofia de la retina y, por tanto, estas patologías hereditarias no se pueden prevenir. Sin embargo, un aspecto en el que sí se puede incidir es en su detección precoz por parte de oftalmólogos especialistas, mediante una revisión ocular completa que incluya una buena anamnesis y una exploración exhaustiva del fondo de ojo, además de técnicas complementarias, como la OCT, la autofluorescencia o las pruebas electrofisiológicas.
A menudo, las distrofias retinianas no son evidentes hasta fases avanzadas, cuando sus síntomas se hacen patentes. Para poder anticiparse a la enfermedad y predecir su evolución, es de gran utilidad conocer la causa molecular que la desencadena en cada paciente a través del diagnóstico genético, que también permite confirmar el diagnóstico clínico, identificar el patrón de herencia y ofrecer consejo genético a la familia, indicando la probabilidad de transmitir la patología y alertando a los familiares portadores.
Asimismo, el diagnóstico genético abre la puerta a prevenir, detener o revertir en el futuro la pérdida de visión de los pacientes afectados, mediante el desarrollo de nuevas terapias individualizadas que están en investigación.
Síntomas
Los síntomas, así como la rapidez de su evolución, varían según el tipo de distrofia de retina y cada paciente. No obstante, los más comunes son:
- Pérdida de agudeza visual: dificultad para apreciar detalles y realizar tareas de precisión.
- Reducción del campo de visión: visión “en túnel” o aparición de “puntos ciegos” (escotomas).
- Ceguera nocturna: problemas para ver de noche o en ambientes oscuros y mala adaptación a situaciones de poca luminosidad.
- Fotofobia y deslumbramientos: especiales molestias ante la luz y visión de “flashes” o reflejos en condiciones de alta luminosidad. El paso de un ambiente claro a un entorno oscuro –y viceversa– también genera problemas.
Otras posibles señales pueden ser la percepción deformada de objetos (metamorfopsia) o la alteración en la percepción de los colores (discromatopsia).
Tratamiento
Las distrofias de la retina actualmente no tienen cura, debido a la dificultad de regenerar las células retinianas afectadas. El futuro tratamiento de estas patologías pasa por el diseño y aplicación de nuevas terapias génicas y celulares que permitan devolver visión o frenar su pérdida.
Actualmente, se están dando pasos importantes en esta línea de investigación (desde 2018, se ha empezado a comercializar la primera terapia génica en Estados Unidos, diseñada para un gen responsable de amaurosis congénita de Leber.
En paralelo, se apuesta por otra vía alternativa y complementaria de tratamiento: la visión artificial, a cuyo desarrollo contribuye participando en estudios con nuevos modelos de chip de retina. Es el caso del IRIS®II, que ha implantado en la primera paciente de Europa.
¿Qué es el chip de retina?
El chip de retina es un sistema de visión artificial que estimula eléctricamente las células nerviosas de la retina –reemplazando la función de las células fotorreceptoras dañadas en algunos pacientes – para, a partir de ahí, transmitir la información visual al cerebro a través del nervio óptico.
De este modo, mediante la percepción de señales de luz y un proceso de rehabilitación visual para aprender a “ver” de forma biónica, pacientes invidentes pueden conseguir localizar e identificar fuentes de luz, objetos y movimiento, contribuyendo a su mayor autonomía y seguridad a la hora de desenvolverse en la vida cotidiana.
Esta compleja tecnología consta de:
- Implante retiniano: microchip de silicona que se coloca en el ojo del paciente (encima o debajo la retina) y contiene los electrodos. A mayor número de electrodos, mayor resolución de las imágenes obtenidas.
- Gafas: incorporan una minicámara bioinspirada en el ojo que imita el funcionamiento de la retina humana y captura a tiempo real los cambios en el campo visual, mediante píxeles independientes.
- Procesador de mano: recibe las imágenes de vídeo y las vuelve a enviar a las gafas en forma de estímulos que puedan ser interpretados por el cerebro. También permite al paciente seleccionar diferentes modos de visión.
La visión biónica, cuyos primeros estudios, hace más de dos décadas, ya contaron con la involucración de los especialistas de IMO, ha experimentado un gran avance. Pixium Vision ha desarrollado el dispositivo IRIS®II, dotado de 150 electrodos y que el Instituto ha implantado de forma pionera, tanto dentro de un ensayo clínico multicéntrico como fuera de investigación por primera vez en Europa.
Asimismo, próximamente se iniciará en IMO el estudio para probar la eficacia y seguridad de un nuevo modelo de chip de retina de la compañía: PRIMA, que dispone de 400 electrodos en su primer prototipo y aspira alcanzar los 1.600 electrodos en versiones más evolucionadas.
Fuente: IMO